医薬品、通販事業支援
医薬品、医薬部外品等のOEMサポート
国や都道府県の承認を得て効果効能を謳うことが可能な医薬品、医薬部外品ですが、実際に製品を設計から量産するまでには関連法規に基づいた開発や申請などの様々な手順が必要となり、時間や費用も多く必要となります。
魅力的な要素が多い反面、製品化が難しいこれらの製品のOEM、ODMを日本薬業では丁寧にアシストしながら行います。
医薬品の業取得サポート

平成25年に薬事法が改正され、全ての一般用医薬品がネットを含む通信販売可能になりました。これにより、今まで健康食品や化粧品を販売していた通信販売企業様でも医薬品を取り扱うことが可能になりました。
しかし、販売を行うには都道府県への「医薬品販売業許可」が必要です。それに伴い、設備的、人的環境を整える必要もあることから非常に複雑だと感じる方が多いのが実情。
日本薬業では、医薬品の企画、OEMの一環として、サポートを致しますのでお気軽にご相談頂けます。
医薬品の分類と販売方法について
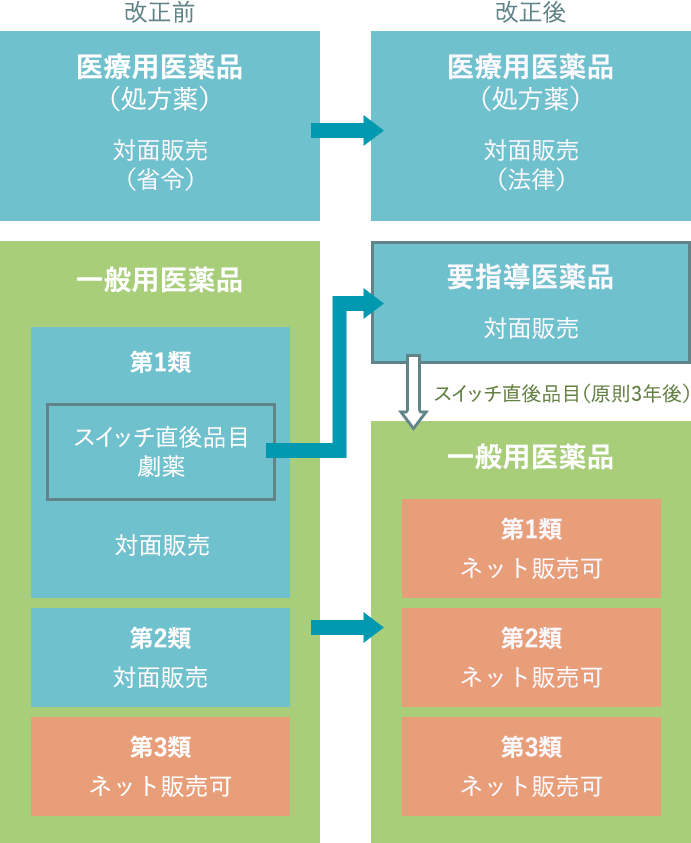
注1)要指導医薬品の指定の要否については、薬事・食品衛生審議会要指導・一般用医薬品部会にて審議。
注2)要指導医薬品から一般用医薬品への移行の可否については、重篤な副作用の発生状況を踏まえ、安全対策調査会にて審議。
注3)薬局製造販売医薬品については、劇薬指定品目を除き、第1類医薬品と同様の販売方法とする。
注4)要指導医薬品は一般用医薬品に移行してから1年間は第一医薬品となる。その後、1年間で1類~3類のいずれに分類するか検討・決定する。
薬事関連
通信販売において、その商品がどのような人にどのように必要であるのかを示すために広告をすることは最も重要です。
医薬品の広告について、1998年9月29日付厚生省医薬安全局監視指導課長通知により、3つの要素が広告に該当するものとされています。
- 顧客を誘引する(顧客の購入意欲を昴進させる)意図が明確であること
- 特定医薬品等の商品名が明らかにされていること
- 一般人が認知できる状態であること

日本薬業では関連法規に基づき、通信販売の広告としてできること、出来ないこと、また、特に注意したいことなど適正な広告基準をサポートします。
